Gambar Partikel Zat Cair Memahami Sifat Fisiknya
- Struktur Mikroskopis Zat Cair
-
- Susunan, Kerapatan, dan Jarak Antar Partikel Zat Cair
- Gerakan dan Interaksi Antar Partikel Zat Cair
- Ilustrasi Interaksi Antar Partikel Zat Cair
- Perbandingan Gerakan Partikel dalam Tiga Fase Materi
- Jenis Gaya Antar Molekul Dominan dalam Zat Cair
- Pengaruh Interaksi Mikroskopis terhadap Sifat Makroskopis Zat Cair
- Perbandingan Perilaku Zat Cair, Padat, dan Gas pada Tingkat Mikroskopis
- Sifat Fisik Zat Cair Berdasarkan Gambar Partikel
- Perubahan Fase Zat Cair Berdasarkan Gambar Partikel
- Pengaruh Suhu terhadap Gerakan Partikel Zat Cair
- Pengaruh Tekanan terhadap Gerakan Partikel Zat Cair
- Zat Cair Murni vs. Larutan Berdasarkan Gambar Partikel
- Campuran Zat Cair Berdasarkan Gambar Partikel
-
- Susunan Partikel dalam Campuran Homogen dan Heterogen
- Ilustrasi Campuran Homogen dan Heterogen
- Metode Pemisahan Campuran Zat Cair
- Identifikasi Jenis Campuran Berdasarkan Gambar Partikel
- Langkah-langkah Identifikasi Jenis Campuran
- Keterbatasan Identifikasi Berdasarkan Gambar Partikel
- Perbedaan Utama Campuran Homogen dan Heterogen
- Permukaan Zat Cair dan Interaksi Partikel
-
- Gaya Antarmolekul dan Bentuk Permukaan Zat Cair
- Interaksi Partikel Permukaan dengan Udara dan Partikel Bawah Permukaan
- Tegangan Permukaan dan Kapilaritas
- Faktor-faktor yang Memengaruhi Tegangan Permukaan
- Fenomena Permukaan Zat Cair
- Perbandingan Permukaan Air dan Merkuri
- Pengukuran Tegangan Permukaan
- Pentingnya Pemahaman Permukaan Zat Cair
- Difusi dan Osmosis dalam Zat Cair
- Viskositas dan Tegangan Permukaan: Gambar Partikel Zat Cair
- Ketegangan Permukaan dan Kapilaritas
- Aplikasi Gambar Partikel dalam Memahami Sifat Zat Cair
-
- Model Partikel Sederhana dan Sifat Fisik Zat Cair
- Aplikasi Pemahaman Sifat Zat Cair Berbasis Gambar Partikel dalam Teknologi
- Tabel Aplikasi Pemahaman Sifat Zat Cair dalam Berbagai Bidang
- Perancangan dan Pengembangan Produk dengan Simulasi Gambar Partikel
- Manfaat Penggunaan Gambar Partikel dalam Memahami Perilaku Zat Cair
- Langkah-Langkah Analisis Sifat Zat Cair Menggunakan Gambar Partikel
- Perbandingan Metode Analisis Sifat Zat Cair
- Keterbatasan dan Cara Mengatasi Keterbatasan Penggunaan Gambar Partikel
- Perbandingan Model Partikel Zat Cair Sederhana dan Kompleks
-
- Model Partikel Zat Cair Sederhana vs. Kompleks: Asumsi Dasar
- Keterbatasan Model Sederhana dalam Menggambarkan Sifat Zat Cair
- Ilustrasi Perbandingan Kedua Model
- Perbandingan Model Sederhana dan Kompleks
- Pentingnya Memilih Model yang Tepat
- Pengaruh Suhu dan Tekanan pada Model Kompleks
- Sifat Zat Cair yang Dijelaskan Lebih Akurat oleh Model Kompleks, Gambar partikel zat cair
- Alur Pemilihan Model Partikel yang Tepat
- Pemodelan Komputer Gerakan Partikel Zat Cair
- Penutupan Akhir
Gambar partikel zat cair, siapa sangka dunia mikroskopis yang tak kasat mata ini menyimpan rahasia di balik sifat-sifat fisik zat cair yang kita kenal sehari-hari? Bayangkan miliaran partikel yang berdesakan, berputar, dan bergetar, menciptakan keajaiban viskositas madu yang lengket, tegangan permukaan air yang membentuk tetesan sempurna, hingga difusi gula yang perlahan melarut dalam kopi. Perjalanan kita kali ini akan menguak misteri di balik gerakan-gerakan mungil tersebut, mengungkap bagaimana susunan, jarak, dan interaksi antar partikel menentukan sifat makroskopis zat cair yang kita amati.
Dari gerakan translasi hingga interaksi antarmolekul, kita akan menyelami dunia mikroskopis zat cair. Kita akan membedah bagaimana gaya-gaya antarmolekul, seperti ikatan hidrogen dan gaya Van der Waals, memengaruhi perilaku zat cair. Dengan bantuan ilustrasi partikel yang menarik, kita akan memahami konsep-konsep seperti viskositas, tegangan permukaan, dan difusi dengan lebih mudah. Siap untuk petualangan ilmiah yang mengasyikkan ini?
Struktur Mikroskopis Zat Cair

Bayangkan dunia yang tak terlihat oleh mata telanjang, dunia di mana molekul-molekul berdansa dan berinteraksi, membentuk zat cair yang kita kenal sehari-hari. Memahami perilaku zat cair membutuhkan menyelami dunia mikroskopisnya, mengungkap rahasia di balik sifat-sifat makroskopis seperti viskositas dan tegangan permukaan. Yuk, kita bongkar misteri ini!
Susunan, Kerapatan, dan Jarak Antar Partikel Zat Cair
Berbeda dengan zat padat yang partikelnya tersusun rapi dan teratur, partikel zat cair lebih longgar. Mereka masih berdekatan, tetapi memiliki lebih banyak ruang gerak dibandingkan dengan zat padat. Kerapatan zat cair berada di antara zat padat dan gas. Jarak antar partikelnya lebih besar daripada zat padat, tetapi lebih kecil daripada gas. Susunan yang kurang teratur ini memungkinkan partikel zat cair untuk mengalir dan menyesuaikan bentuk sesuai wadahnya. Hal ini berbeda dengan zat padat yang mempertahankan bentuknya dan gas yang mengisi seluruh ruang yang tersedia.
Gerakan dan Interaksi Antar Partikel Zat Cair
Partikel zat cair tak pernah diam! Mereka bergerak secara translasi (bergerak dari satu tempat ke tempat lain), rotasi (berputar pada sumbunya), dan vibrasi (bergetar di tempat). Energi kinetik menentukan kecepatan gerakan, sementara energi potensial mencerminkan gaya tarik-menarik antar partikel. Interaksi ini bisa berupa gaya Van der Waals, ikatan hidrogen, atau gaya-gaya antarmolekul lainnya, tergantung jenis zat cairnya. Suhu berperan penting; suhu tinggi meningkatkan energi kinetik, membuat partikel bergerak lebih cepat dan interaksi antarmolekul menjadi lebih lemah.
Ilustrasi Interaksi Antar Partikel Zat Cair
Bayangkan lima bola kecil yang mewakili partikel zat cair. Tiga di antaranya saling berdekatan, dihubungkan oleh garis-garis biru tipis yang melambangkan gaya Van der Waals yang relatif lemah. Dua bola lainnya sedikit lebih terpisah, terhubung oleh garis-garis merah yang lebih tebal, menggambarkan ikatan hidrogen yang lebih kuat. Posisi bola-bola tersebut tidak tetap dan terus berubah, menggambarkan sifat dinamis zat cair. Beberapa bola mungkin saling mendekat, sementara yang lain bergerak menjauh, menggambarkan keseimbangan antara gaya tarik-menarik dan energi kinetik.
Perbandingan Gerakan Partikel dalam Tiga Fase Materi
| Fase Materi | Gerakan Translasi | Gerakan Rotasi | Gerakan Vibrasi |
|---|---|---|---|
| Padat | Terbatas, getaran di tempat | Terbatas, getaran di tempat | Signifikan, getaran di tempat |
| Cair | Relatif bebas, bergerak dan bergeser | Relatif bebas, berputar | Signifikan, getaran dan rotasi |
| Gas | Sangat bebas, bergerak acak | Sangat bebas, berputar bebas | Relatif kecil, gerakan acak dominan |
Jenis Gaya Antar Molekul Dominan dalam Zat Cair
Gaya antar molekul yang dominan dalam zat cair bervariasi tergantung jenis zat cairnya. Air, misalnya, didominasi oleh ikatan hidrogen yang relatif kuat. Minyak, di sisi lain, didominasi oleh gaya dispersi London yang lebih lemah. Kekuatan relatif gaya antar molekul ini menentukan sifat-sifat makroskopis zat cair, seperti titik didih dan viskositas.
Pengaruh Interaksi Mikroskopis terhadap Sifat Makroskopis Zat Cair
Interaksi mikroskopis antar partikel secara langsung mempengaruhi sifat makroskopis zat cair. Viskositas, misalnya, mencerminkan hambatan terhadap aliran. Zat cair dengan gaya antar molekul yang kuat cenderung memiliki viskositas yang lebih tinggi karena partikelnya lebih sulit untuk bergerak melewati satu sama lain. Tegangan permukaan, kemampuan zat cair untuk meminimalkan luas permukaannya, juga dipengaruhi oleh gaya antar molekul. Difusi, proses penyebaran partikel, dipengaruhi oleh energi kinetik partikel dan ruang antar partikel.
Perbandingan Perilaku Zat Cair, Padat, dan Gas pada Tingkat Mikroskopis
Zat padat memiliki partikel yang tersusun rapat dan teratur, dengan gerakan yang terbatas. Zat cair memiliki partikel yang lebih longgar dan bergerak lebih bebas. Zat gas memiliki partikel yang tersebar jauh dan bergerak secara acak. Perbedaan ini menjelaskan perbedaan sifat makroskopis antara ketiga fase materi tersebut.
Sifat Fisik Zat Cair Berdasarkan Gambar Partikel
Gambar partikel zat cair memberikan gambaran visual yang sangat membantu untuk memahami sifat-sifat fisiknya. Dengan mengamati jarak, susunan, dan interaksi antar partikel, kita bisa menjelaskan berbagai karakteristik zat cair seperti viskositas, tegangan permukaan, dan difusi. Mari kita telusuri lebih dalam bagaimana ilustrasi partikel tersebut menjelaskan sifat-sifat unik zat cair.
Viskositas Zat Cair
Viskositas menggambarkan kekentalan suatu zat cair, atau hambatan terhadap aliran. Pada gambar partikel, zat cair dengan viskositas tinggi ditunjukkan dengan partikel yang berdekatan dan gaya antar partikel yang kuat. Hal ini menyebabkan hambatan yang signifikan terhadap pergerakan partikel satu sama lain, sehingga alirannya menjadi lambat. Contohnya adalah madu, yang partikel-partikelnya saling berinteraksi kuat, sehingga alirannya lambat. Sebaliknya, zat cair dengan viskositas rendah, seperti air, ditunjukkan dengan partikel yang lebih terpisah dan gaya antar partikel yang lebih lemah. Partikel-partikelnya lebih mudah bergerak, sehingga alirannya lebih lancar.
Tegangan Permukaan Zat Cair
Tegangan permukaan adalah kecenderungan permukaan zat cair untuk menegang dan meminimalkan luas permukaannya. Hal ini disebabkan oleh gaya kohesi yang kuat antar partikel pada permukaan. Partikel di permukaan hanya dikelilingi oleh partikel lain di bawahnya dan di sampingnya, sehingga mengalami gaya tarik ke dalam yang lebih kuat dibandingkan partikel di dalam zat cair. Bayangkan seperti sekelompok orang yang saling berpegangan tangan membentuk lingkaran – mereka saling menarik ke tengah, menciptakan tegangan di tepi lingkaran. Ilustrasi partikel akan menunjukkan gaya kohesi yang mengarah ke dalam pada partikel permukaan, membentuk semacam lapisan “kulit” yang menegang.
Ilustrasi: (Bayangkan sketsa sederhana dengan beberapa lingkaran yang mewakili partikel air. Partikel di permukaan ditunjukkan dengan anak panah yang menunjuk ke dalam, menggambarkan gaya kohesi yang menarik partikel ke bawah dan ke dalam.)
Difusi dalam Zat Cair
Difusi adalah proses penyebaran partikel dari daerah berkonsentrasi tinggi ke daerah berkonsentrasi rendah. Pada gambar partikel, kita dapat melihat pergerakan acak partikel-partikel zat terlarut di dalam pelarut. Seiring waktu, partikel-partikel zat terlarut akan tersebar merata di seluruh pelarut. Ilustrasi partikel akan menunjukkan konsentrasi zat terlarut yang awalnya terkonsentrasi di satu area, kemudian menyebar secara bertahap hingga merata di seluruh wadah. Laju difusi dipengaruhi oleh suhu; suhu yang lebih tinggi akan meningkatkan energi kinetik partikel, sehingga difusi terjadi lebih cepat.
Ilustrasi: (Bayangkan dua sketsa. Sketsa pertama menunjukkan partikel zat terlarut yang terkonsentrasi di satu sisi wadah. Sketsa kedua menunjukkan partikel zat terlarut yang telah menyebar merata di seluruh wadah setelah beberapa waktu.)
Hubungan Kerapatan Partikel dan Massa Jenis Zat Cair
Hubungan antara kerapatan partikel dan massa jenis zat cair sangat erat. Kerapatan partikel yang lebih tinggi menunjukkan jumlah partikel per satuan volume yang lebih besar, yang secara langsung berkorelasi dengan massa yang lebih besar per satuan volume, sehingga menghasilkan massa jenis yang lebih tinggi. Rumus massa jenis adalah ρ = m/V, di mana ρ adalah massa jenis, m adalah massa, dan V adalah volume.
Aliran Zat Cair dan Viskositas
Kemampuan zat cair untuk mengalir, atau fluiditasnya, dipengaruhi oleh viskositas. Zat cair dengan viskositas rendah akan mengalir lebih mudah karena partikelnya lebih mudah bergerak. Sebaliknya, zat cair dengan viskositas tinggi akan mengalir lebih lambat karena partikelnya lebih sulit bergerak. Ilustrasi akan menunjukkan perbedaan jarak dan gaya antar partikel pada kedua jenis zat cair ini.
Ilustrasi 1: (Bayangkan ilustrasi partikel zat cair dengan viskositas rendah, dengan partikel yang tersebar dan jarak antar partikel yang relatif jauh, menunjukkan aliran yang lancar.)
Ilustrasi 2: (Bayangkan ilustrasi partikel zat cair dengan viskositas tinggi, dengan partikel yang berdekatan dan jarak antar partikel yang relatif dekat, menunjukkan aliran yang lambat dan sulit.)
Perbandingan Sifat Zat Cair, Padat, dan Gas
| Sifat Fisik | Zat Cair | Zat Padat | Zat Gas |
|---|---|---|---|
| Jarak Antar Partikel | Relatif dekat, tetapi lebih jauh daripada zat padat | Sangat dekat | Sangat jauh |
| Gaya Antar Partikel | Lemah, tetapi lebih kuat daripada zat gas | Sangat kuat | Sangat lemah |
| Viskositas | Beragam, tergantung jenis zat cair | Sangat tinggi | Sangat rendah |
| Tegangan Permukaan | Ada | Tidak ada | Tidak ada |
| Difusi | Terjadi, tetapi lebih lambat daripada gas | Sangat lambat | Sangat cepat |
Pengaruh Suhu terhadap Sifat Fisik Zat Cair
Peningkatan suhu akan meningkatkan energi kinetik partikel zat cair. Hal ini akan menyebabkan jarak antar partikel meningkat, gaya antar partikel melemah, dan viskositas menurun. Difusi akan meningkat karena partikel bergerak lebih cepat dan lebih acak. Tegangan permukaan juga dapat sedikit berkurang karena gaya kohesi antar partikel melemah.
Ilustrasi: (Bayangkan dua ilustrasi yang menunjukkan partikel zat cair pada suhu rendah dan suhu tinggi. Pada suhu tinggi, partikel akan lebih tersebar dan bergerak lebih cepat.)
Perubahan Fase Zat Cair Berdasarkan Gambar Partikel
Perubahan fase zat cair, seperti penguapan, pengembunan, dan pembekuan, merupakan fenomena sehari-hari yang dapat dijelaskan dengan mengamati pergerakan dan interaksi partikel penyusunnya. Memahami hal ini akan memberikan gambaran yang lebih komprehensif tentang sifat materi dan bagaimana energi memengaruhi perubahan wujudnya. Berikut penjelasan lebih detail tentang perubahan fase zat cair berdasarkan ilustrasi partikel.
Penguapan Zat Cair
Penguapan adalah proses perubahan zat cair menjadi gas. Pada ilustrasi, kita dapat melihat lima partikel air dalam keadaan cair. Sebelum penguapan, partikel-partikel tersebut berdekatan, bergerak dengan kecepatan rendah dan acak. Jarak antar partikel relatif rapat. Setelah menerima energi panas, beberapa partikel air akan bergerak lebih cepat, energi kinetiknya meningkat, dan beberapa partikel mengalami peningkatan kecepatan yang signifikan hingga mampu mengatasi gaya tarik antar partikel. Partikel-partikel ini kemudian terlepas dari permukaan air dan berubah menjadi uap air, yang ditunjukkan dengan partikel-partikel yang lebih tersebar dan bergerak dengan kecepatan yang jauh lebih tinggi. Panah menunjukkan arah gerakan partikel yang semakin cepat dan menjauhi permukaan air. Ilustrasi akan menampilkan partikel air berwarna biru tua dalam keadaan cair dan berwarna biru muda setelah berubah menjadi uap air, dengan kecepatan dan jarak antar partikel yang jelas berbeda.
Pengembunan Zat Cair
Pengembunan adalah kebalikan dari penguapan, yaitu proses perubahan uap air menjadi air cair. Ilustrasi menunjukkan lima partikel uap air (warna biru muda) yang bergerak cepat dan acak. Ketika uap air bersentuhan dengan permukaan yang lebih dingin (misalnya, permukaan kaca pada suhu rendah), energi kinetik partikel uap air akan menurun. Hal ini disebabkan oleh pelepasan energi panas ke lingkungan. Penurunan energi kinetik menyebabkan kecepatan partikel uap air berkurang dan gaya tarik antar molekul air menjadi lebih dominan. Akibatnya, partikel-partikel uap air tersebut akan saling mendekat dan membentuk tetesan air (warna biru tua). Suhu lingkungan yang lebih rendah dan tekanan udara yang cukup akan mendukung proses pengembunan ini. Ilustrasi akan menunjukkan perubahan warna partikel dan jarak antar partikel yang semakin rapat.
Perbandingan Energi Kinetik Penguapan dan Pengembunan
| Proses | Energi Kinetik Rata-rata Partikel | Jarak Antar Partikel | Kecepatan Partikel |
|---|---|---|---|
| Penguapan | Meningkat | Meningkat | Meningkat |
| Pengembunan | Menurun | Menurun | Menurun |
Pembekuan Zat Cair
Pembekuan adalah proses perubahan zat cair menjadi padat. Ilustrasi akan menunjukkan sepuluh partikel air dalam keadaan cair yang bergerak relatif bebas. Ketika suhu menurun, energi kinetik partikel air menurun, menyebabkan kecepatan gerakan partikel berkurang. Gaya tarik antar partikel menjadi lebih dominan, sehingga partikel-partikel air tersebut akan saling mendekat dan tersusun secara teratur membentuk struktur kristal es. Jarak antar partikel menjadi lebih rapat dan gerakannya menjadi lebih terbatas. Ilustrasi akan menunjukkan perubahan susunan partikel dari acak menjadi teratur, dengan keterangan penurunan suhu yang signifikan.
Sublimasi Zat Cair
Sublimasi, yaitu perubahan fase langsung dari padat ke gas atau sebaliknya, tidak mungkin terjadi pada zat cair. Sublimasi hanya terjadi pada zat padat yang memiliki tekanan uap yang cukup tinggi pada suhu rendah. Contohnya adalah kapur barus yang dapat menyublim pada suhu ruang. Zat cair akan terlebih dahulu berubah menjadi gas (penguapan) sebelum mengalami proses sublimasi.
Pengaruh Suhu terhadap Gerakan Partikel Zat Cair
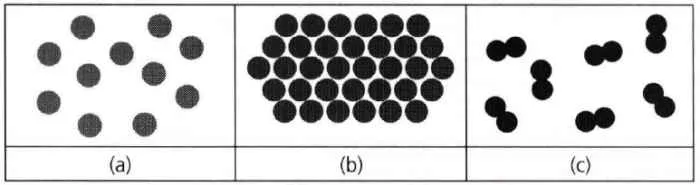
Bayangkan segelas air. Semakin panas airnya, semakin cepat es batu di dalamnya mencair, kan? Itu karena suhu berpengaruh besar terhadap gerakan partikel-partikel penyusun zat cair. Nah, artikel ini akan mengupas tuntas bagaimana suhu mempengaruhi energi kinetik, jarak antar partikel, dan sifat-sifat zat cair lainnya!
Energi Kinetik Partikel dan Suhu
Peningkatan suhu menyebabkan peningkatan energi kinetik partikel zat cair. Semakin tinggi suhu, semakin cepat partikel-partikel tersebut bergerak dan bergetar. Energi kinetik ini adalah energi gerak yang dimiliki oleh partikel. Bayangkan seperti ini: partikel-partikel pada air dingin seperti anak-anak yang sedang tidur siang, bergerak pelan dan malas. Sedangkan partikel-partikel pada air panas seperti anak-anak yang sedang bermain di taman, berlarian kesana kemari dengan penuh energi!
Jarak Antar Partikel dan Suhu
Perubahan suhu juga memengaruhi jarak antar partikel zat cair. Dengan peningkatan suhu dan energi kinetik, partikel-partikel akan bergerak lebih cepat dan lebih jauh, sehingga jarak antar mereka cenderung meningkat. Ini mirip seperti ketika kita menaikkan suhu dalam sebuah ruangan, orang-orang di dalamnya akan cenderung menyebar untuk mendapatkan ruang gerak yang lebih luas.
Ilustrasi Gerakan Partikel pada Suhu Berbeda
Coba bayangkan dua gambar. Gambar pertama menunjukkan partikel-partikel zat cair yang berdekatan dan bergerak lambat pada suhu rendah. Mereka saling berhimpitan, gerakannya terbatas dan teratur. Sedangkan gambar kedua menunjukkan partikel-partikel yang tersebar lebih jauh dan bergerak lebih cepat dan acak pada suhu tinggi. Mereka bergerak bebas dan saling bertabrakan dengan energi yang lebih besar. Perbedaan ini sangat signifikan dan mencerminkan bagaimana suhu mengubah dinamika gerakan partikel.
Suhu dan Viskositas Zat Cair
Viskositas adalah ukuran kekentalan suatu zat cair. Semakin tinggi viskositas, semakin sulit zat cair tersebut mengalir. Suhu memiliki pengaruh terbalik terhadap viskositas. Suhu yang tinggi menurunkan viskositas, sementara suhu yang rendah meningkatkan viskositas. Bayangkan madu, pada suhu rendah ia sangat kental dan sulit dituang, namun ketika dipanaskan, ia menjadi lebih encer dan mudah mengalir.
Suhu dan Laju Difusi dalam Zat Cair
Difusi adalah proses penyebaran partikel dari daerah berkonsentrasi tinggi ke daerah berkonsentrasi rendah. Peningkatan suhu meningkatkan laju difusi dalam zat cair. Hal ini karena partikel-partikel bergerak lebih cepat pada suhu tinggi, sehingga proses penyebarannya menjadi lebih efisien. Contohnya, jika kita meneteskan tinta ke dalam air dingin, proses penyebaran tinta akan lebih lambat dibandingkan jika kita meneteskannya ke dalam air panas. Partikel tinta akan lebih cepat menyebar di air panas karena partikel air bergerak lebih cepat dan membantu proses penyebaran tersebut.
Pengaruh Tekanan terhadap Gerakan Partikel Zat Cair

Pernah nggak sih kamu mikir, gimana sih sebenarnya partikel-partikel kecil penyusun air itu bereaksi kalau kita tekan? Ternyata, tekanan punya pengaruh besar banget, lho, terhadap jarak, gerakan, bahkan volume zat cair! Kita akan bahas lebih dalam tentang bagaimana tekanan mengubah perilaku partikel-partikel ini.
Jarak Antar Partikel Zat Cair pada Tekanan Berbeda
Peningkatan tekanan pada zat cair menyebabkan jarak antar partikelnya berkurang. Bayangkan kamu menekan balon berisi air—air di dalamnya akan tertekan dan partikel-partikelnya jadi lebih rapat. Hal ini terjadi karena gaya tekan luar memaksa partikel-partikel untuk mendekat satu sama lain. Semakin besar tekanan yang diberikan, semakin kecil jarak antar partikelnya.
Pengaruh Tekanan terhadap Volume Zat Cair
Secara umum, zat cair memiliki volume yang relatif tetap. Namun, peningkatan tekanan akan sedikit mengurangi volume zat cair. Pengaruhnya memang kecil, tapi tetap ada. Ini karena partikel-partikel zat cair yang semula agak renggang, terdorong mendekat sehingga volume keseluruhan berkurang sedikit. Bayangkan lagi balon tadi, volumenya sedikit mengecil saat ditekan.
Ilustrasi Susunan Partikel pada Tekanan Rendah dan Tinggi
Coba bayangkan dua gambar. Gambar pertama menunjukkan partikel-partikel zat cair tersebar agak renggang, dengan ruang kosong di antaranya. Ini menggambarkan kondisi tekanan rendah. Gambar kedua menunjukkan partikel-partikel yang berhimpitan rapat, dengan sedikit sekali ruang kosong. Ini menggambarkan kondisi tekanan tinggi. Perbedaan jarak antar partikel ini menunjukkan bagaimana tekanan memengaruhi kerapatan zat cair.
Hubungan Tekanan dan Kerapatan Zat Cair
Tekanan dan kerapatan zat cair memiliki hubungan yang berbanding lurus. Semakin tinggi tekanan yang diberikan pada zat cair, semakin rapat partikel-partikelnya, sehingga kerapatannya meningkat. Sebaliknya, jika tekanan rendah, kerapatannya juga akan rendah. Perubahan kerapatan ini, meskipun kecil pada zat cair, tetap signifikan dalam beberapa aplikasi ilmiah dan teknologi.
Perubahan Gerakan Partikel Zat Cair Akibat Perubahan Tekanan
Perubahan tekanan juga mempengaruhi gerakan partikel zat cair. Pada tekanan tinggi, partikel-partikel bergerak lebih lambat dan lebih terbatas karena ruang gerak mereka berkurang. Mereka lebih sering bertabrakan satu sama lain. Sebaliknya, pada tekanan rendah, partikel-partikel memiliki lebih banyak ruang untuk bergerak dan kecepatannya cenderung lebih tinggi. Hal ini analog dengan keramaian di sebuah konser; semakin ramai (tekanan tinggi), semakin sulit bergerak.
Zat Cair Murni vs. Larutan Berdasarkan Gambar Partikel

Bayangkan kamu sedang mengamati sekelompok partikel di bawah mikroskop super canggih. Ada dua kelompok: satu kelompok partikel yang seragam, kompak, dan bergerak dengan harmonis. Kelompok lainnya, lebih ramai, dengan partikel-partikel berbeda ukuran dan jenis yang bercampur aduk. Perbedaan ini menggambarkan perbedaan mendasar antara zat cair murni dan larutan. Mari kita telusuri lebih dalam perbedaan susunan dan perilaku partikel pada kedua jenis zat cair ini.
Perbedaan Susunan Partikel Zat Cair Murni dan Larutan
Pada zat cair murni, misalnya air murni (H₂O), partikel-partikelnya identik. Mereka tersusun rapat namun masih dapat bergerak bebas, saling bergeser dan bertukar tempat. Susunannya teratur dan homogen. Berbeda dengan larutan, misalnya air garam. Di sini, kamu akan melihat dua jenis partikel: partikel air (H₂O) sebagai pelarut dan partikel garam (NaCl) sebagai zat terlarut. Partikel garam tersebar di antara partikel air, menciptakan campuran yang homogen. Susunannya terlihat lebih acak dibandingkan zat cair murni.
Penyebaran Partikel Zat Terlarut di Antara Partikel Pelarut
Bayangkan kamu mencampurkan gula ke dalam air. Awalnya, butiran gula terlihat terpisah. Namun, seiring waktu, gula akan larut. Partikel-partikel gula (zat terlarut) akan tersebar secara merata di antara partikel-partikel air (pelarut). Proses ini terjadi karena interaksi antara partikel gula dan air. Molekul air akan mengelilingi ion-ion gula, memisahkannya dan mendistribusikannya secara acak di seluruh larutan. Proses ini menghasilkan campuran yang homogen, di mana setiap bagian larutan memiliki komposisi yang sama.
Ilustrasi Gerakan Partikel dalam Zat Cair Murni dan Larutan
Coba bayangkan animasi sederhana. Pada zat cair murni, partikel-partikelnya bergerak dengan pola yang relatif teratur, seperti tarian yang terkoordinasi. Mereka saling bergeser, tetapi gerakannya masih terkendali. Sebaliknya, dalam larutan, gerakan partikel lebih acak dan energetik, seperti kerumunan orang yang ramai. Partikel pelarut dan zat terlarut bergerak secara independen, bertabrakan, dan berinteraksi satu sama lain. Kecepatan dan arah gerakannya bervariasi, mencerminkan energi kinetik yang lebih tinggi pada larutan dibandingkan zat cair murni pada suhu yang sama.
Perbandingan Sifat Fisik Zat Cair Murni dan Larutan
| Sifat | Zat Cair Murni | Larutan |
|---|---|---|
| Titik Didih | Tetap | Berubah (umumnya lebih tinggi dari pelarut murni) |
| Titik Beku | Tetap | Berubah (umumnya lebih rendah dari pelarut murni) |
| Densitas | Tetap | Berubah (tergantung konsentrasi zat terlarut) |
Faktor yang Memengaruhi Kelarutan Zat dalam Zat Cair
Beberapa faktor kunci memengaruhi seberapa baik suatu zat dapat larut dalam cairan. Jenis interaksi antarmolekul antara zat terlarut dan pelarut sangat krusial. Misalnya, zat polar lebih mudah larut dalam pelarut polar (seperti air), sedangkan zat nonpolar lebih mudah larut dalam pelarut nonpolar (seperti minyak). Suhu juga berperan; peningkatan suhu biasanya meningkatkan kelarutan. Tekanan juga dapat memengaruhi kelarutan, terutama untuk gas yang larut dalam cairan. Semakin tinggi tekanan, semakin banyak gas yang dapat larut.
Campuran Zat Cair Berdasarkan Gambar Partikel
Dunia mikroskopis menyimpan rahasia menarik tentang bagaimana zat cair bercampur. Melihat susunan partikel pada skala mikroskopis (misalnya, perbesaran 1000x) membuka jendela untuk memahami perbedaan antara campuran homogen dan heterogen. Artikel ini akan mengupas tuntas bagaimana partikel-partikel tersebut berinteraksi, metode pemisahannya, dan bagaimana kita mengidentifikasi jenis campuran berdasarkan gambar partikelnya.
Susunan Partikel dalam Campuran Homogen dan Heterogen
Pada perbesaran mikroskopis sekitar 1000x, campuran homogen menunjukkan distribusi partikel yang seragam. Bayangkan sepuluh partikel air (H₂O) dan sepuluh partikel gula (C₁₂H₂₂O₁₁) yang tercampur sempurna. Anda tidak akan mampu membedakan partikel air dan gula secara visual, karena mereka bercampur secara merata. Interaksi antarmolekul didominasi oleh ikatan hidrogen antara molekul air dan gaya Van der Waals antara molekul gula dan air. Sebaliknya, campuran heterogen menunjukkan pengelompokan partikel yang jelas. Jika kita mengamati campuran pasir dan air, sepuluh partikel pasir (SiO₂) akan terlihat terpisah dan berkumpul, tidak bercampur sempurna dengan sepuluh partikel air. Gaya antarmolekul utama di sini adalah ikatan hidrogen antar molekul air, sementara interaksi antara pasir dan air relatif lemah.
Ilustrasi Campuran Homogen dan Heterogen
Campuran Homogen: Ilustrasi menunjukkan distribusi partikel yang merata. Misalnya, larutan garam dalam air pada perbesaran 1000x akan memperlihatkan ion-ion natrium (Na⁺) dan klorida (Cl⁻) yang tersebar merata di antara molekul-molekul air. Skala: 1 unit = 1 mikrometer.
Campuran Heterogen: Ilustrasi menampilkan partikel-partikel yang terpisah dan tidak terdistribusi secara merata. Misalnya, campuran pasir dan air akan memperlihatkan butiran pasir yang terpisah dan berkumpul, tidak tercampur sempurna dengan molekul-molekul air. Skala: 1 unit = 10 mikrometer.
Metode Pemisahan Campuran Zat Cair
Ada beberapa metode untuk memisahkan campuran zat cair, tergantung pada sifat partikelnya. Penyaringan memisahkan padatan dari cairan menggunakan media berpori. Destilasi memanfaatkan perbedaan titik didih komponen untuk memisahkannya. Kromatografi memisahkan komponen berdasarkan perbedaan afinitas terhadap fase diam dan fase gerak.
Contoh aplikasi penyaringan adalah menyaring air teh untuk memisahkan ampas teh. Destilasi digunakan dalam pembuatan minuman keras, memisahkan alkohol dari air. Kromatografi digunakan dalam laboratorium untuk memisahkan berbagai senyawa dalam suatu sampel.
| Metode Pemisahan | Prinsip Kerja | Contoh Aplikasi | Efektif untuk Homogen | Efektif untuk Heterogen |
|---|---|---|---|---|
| Penyaringan | Memisahkan padatan dari cairan menggunakan media berpori. | Menyaring air teh. | Tidak | Ya |
| Destilasi | Memanfaatkan perbedaan titik didih komponen untuk memisahkannya. | Pembuatan minuman keras. | Ya | Ya (untuk memisahkan komponen cair) |
| Kromatografi | Memisahkan komponen berdasarkan perbedaan afinitas terhadap fase diam dan fase gerak. | Analisis senyawa dalam sampel laboratorium. | Ya | Ya |
Identifikasi Jenis Campuran Berdasarkan Gambar Partikel
Mengidentifikasi jenis campuran berdasarkan gambar partikel memerlukan analisis visual yang cermat. Gambar yang menunjukkan distribusi partikel yang seragam mengindikasikan campuran homogen, sementara gambar dengan partikel yang terpisah dan berkumpul menandakan campuran heterogen. Perlu diingat bahwa resolusi gambar dan skala perbesaran sangat memengaruhi akurasi identifikasi.
Langkah-langkah Identifikasi Jenis Campuran
Diagram alir untuk mengidentifikasi jenis campuran berdasarkan gambar partikel akan dimulai dengan mengamati distribusi partikel. Jika partikel terdistribusi secara merata, maka campuran tersebut homogen. Jika partikel terdistribusi tidak merata atau membentuk kelompok, maka campuran tersebut heterogen.
Keterbatasan Identifikasi Berdasarkan Gambar Partikel
Mengidentifikasi jenis campuran hanya berdasarkan gambar partikel memiliki keterbatasan. Resolusi gambar, skala perbesaran, dan kemungkinan adanya artefak selama pengambilan gambar dapat memengaruhi akurasi identifikasi. Selain itu, beberapa campuran mungkin tampak homogen pada skala tertentu, tetapi heterogen pada skala yang lebih kecil.
Perbedaan Utama Campuran Homogen dan Heterogen
Perbedaan utama antara campuran homogen dan heterogen terletak pada distribusi partikelnya. Campuran homogen menunjukkan distribusi partikel yang seragam dan merata, sementara campuran heterogen menunjukkan distribusi partikel yang tidak merata dan cenderung membentuk kelompok atau fase yang terpisah. Hal ini tercermin dalam interaksi antarmolekul yang terjadi di dalam campuran.
Permukaan Zat Cair dan Interaksi Partikel
Dunia mikroskopis zat cair menyimpan rahasia menarik yang memengaruhi kehidupan kita sehari-hari. Permukaan zat cair, yang tampak sederhana, sebenarnya merupakan arena interaksi rumit antara partikel-partikel penyusunnya, dipengaruhi oleh gaya-gaya antarmolekul dan lingkungan sekitarnya. Memahami interaksi ini membuka jendela ke fenomena menarik seperti tegangan permukaan dan kapilaritas, yang berperan penting dalam berbagai proses alam dan teknologi.
Gaya Antarmolekul dan Bentuk Permukaan Zat Cair
Gaya kohesi, yaitu gaya tarik-menarik antarpartikel *sejenis*, dan gaya adhesi, yaitu gaya tarik-menarik antarpartikel *berbeda jenis*, menentukan bentuk permukaan zat cair. Air, dengan gaya kohesi yang kuat dan gaya adhesi yang cukup tinggi terhadap kaca, membentuk permukaan cekung (meniskus cekung) dalam tabung kaca. Sebaliknya, merkuri, dengan gaya kohesi yang sangat kuat dan gaya adhesi yang lemah terhadap kaca, membentuk permukaan cembung (meniskus cembung). Perbedaan ini menghasilkan tegangan permukaan yang berbeda; air memiliki tegangan permukaan yang lebih tinggi daripada merkuri.
Interaksi Partikel Permukaan dengan Udara dan Partikel Bawah Permukaan
Partikel di permukaan zat cair mengalami gaya tarik-menarik yang tidak seimbang dibandingkan dengan partikel di dalam volume zat cair. Partikel dalam volume dikelilingi oleh partikel sejenis yang menariknya ke segala arah, sehingga gaya-gaya tersebut saling meniadakan. Namun, partikel permukaan hanya ditarik oleh partikel di bawahnya dan di sampingnya, menghasilkan gaya resultan ke arah dalam. Ini menyebabkan energi potensial partikel permukaan lebih tinggi daripada partikel dalam volume. Ilustrasi diagram energi potensial akan menunjukkan perbedaan energi ini, dengan energi potensial partikel permukaan berada pada tingkat energi yang lebih tinggi.
Tegangan Permukaan dan Kapilaritas
Ilustrasi tegangan permukaan dapat digambarkan sebagai lapisan tipis pada permukaan zat cair yang cenderung meminimalkan luas permukaannya. Kapilaritas, di sisi lain, menggambarkan naik atau turunnya zat cair dalam tabung kapiler sempit akibat interaksi antara gaya kohesi dan adhesi. Dalam tabung kapiler yang sempit, adhesi air terhadap dinding kaca lebih kuat daripada kohesi antarmolekul air, sehingga air naik ke atas membentuk meniskus cekung. Semakin sempit diameter tabung kapiler, semakin tinggi air akan naik. Sebaliknya, merkuri dengan kohesi yang dominan akan turun dan membentuk meniskus cembung.
Faktor-faktor yang Memengaruhi Tegangan Permukaan
| Faktor | Penjelasan | Pengaruh terhadap Tegangan Permukaan | Contoh |
|---|---|---|---|
| Suhu | Energi kinetik partikel meningkat seiring suhu. | Menurun seiring peningkatan suhu. | Tegangan permukaan air lebih rendah pada suhu 80°C daripada pada suhu 20°C. |
| Jenis Zat Cair | Kekuatan gaya antarmolekul berbeda antar zat cair. | Zat cair dengan gaya antarmolekul kuat memiliki tegangan permukaan yang tinggi. | Air memiliki tegangan permukaan yang lebih tinggi daripada alkohol. |
| Adanya Zat Terlarut | Zat terlarut dapat mengubah gaya antarmolekul. | Bergantung pada jenis zat terlarut; dapat meningkatkan atau menurunkan tegangan permukaan. | Penambahan sabun menurunkan tegangan permukaan air. |
Fenomena Permukaan Zat Cair
-
Fenomena: Pembentukan Tetesan
Penjelasan: Tegangan permukaan meminimalkan luas permukaan, membentuk tetesan bulat.
Contoh: Tetesan air hujan. -
Fenomena: Kapilaritas
Penjelasan: Naik atau turunnya zat cair dalam tabung sempit akibat interaksi gaya kohesi dan adhesi.
Contoh: Air naik di dalam batang tanaman. -
Fenomena: Gerakan serangga di permukaan air
Penjelasan: Tegangan permukaan air cukup kuat untuk menahan berat serangga.
Contoh: Water strider berjalan di permukaan air. -
Fenomena: Pembentukan busa
Penjelasan: Udara terperangkap di dalam lapisan tipis zat cair, distabilkan oleh tegangan permukaan.
Contoh: Busa sabun. -
Fenomena: Meniskus
Penjelasan: Permukaan cekung atau cembung zat cair dalam tabung sempit akibat interaksi gaya kohesi dan adhesi.
Contoh: Meniskus cekung pada air dan meniskus cembung pada merkuri dalam tabung kaca.
Perbandingan Permukaan Air dan Merkuri
Air dan merkuri menunjukkan perilaku permukaan yang berbeda karena perbedaan gaya kohesi dan adhesi. Air memiliki sudut kontak yang kecil terhadap kaca (meniskus cekung), menunjukkan adhesi yang lebih kuat daripada kohesi. Merkuri, sebaliknya, memiliki sudut kontak yang besar (meniskus cembung), menunjukkan kohesi yang lebih dominan daripada adhesi terhadap kaca.
Pengukuran Tegangan Permukaan
Tegangan permukaan dapat diukur menggunakan beberapa metode. Metode Stalagmometer mengukur jumlah tetesan yang terbentuk saat cairan menetes dari suatu pipa kapiler. Metode cincin Du Noüy menggunakan cincin platinum yang ditarik keluar dari permukaan cairan, dan gaya yang dibutuhkan untuk melepaskan cincin diukur. Gaya ini berbanding lurus dengan tegangan permukaan.
Pentingnya Pemahaman Permukaan Zat Cair
Memahami permukaan zat cair dan interaksi partikelnya sangat penting dalam berbagai aplikasi, dari desain material hingga proses biologis. Tegangan permukaan memengaruhi kemampuan pembersihan deterjen, pergerakan cairan dalam sistem biologis, dan efisiensi proses manufaktur. Pengetahuan ini memungkinkan pengembangan teknologi yang lebih baik dan pemahaman yang lebih mendalam tentang dunia di sekitar kita.
Difusi dan Osmosis dalam Zat Cair

Pernah ngebayangin gimana gula bisa larut sempurna dalam segelas teh manis? Atau bagaimana air bergerak dari akar ke daun tumbuhan yang tinggi menjulang? Rahasianya ada pada dua proses keren di dunia mikroskopis: difusi dan osmosis. Kedua proses ini menjelaskan bagaimana partikel-partikel dalam zat cair bergerak dan berinteraksi, membentuk dasar dari banyak proses kehidupan dan fenomena alam sehari-hari.
Gerakan Partikel dalam Difusi Zat Cair
Bayangkan kamu menjatuhkan setetes tinta ke dalam segelas air bening. Apa yang terjadi? Tinta tersebut perlahan-lahan akan menyebar, sampai akhirnya seluruh air berubah warna. Itulah difusi! Proses ini terjadi karena partikel-partikel tinta bergerak secara acak dan bertabrakan satu sama lain, serta dengan molekul air. Gerakan ini, yang didorong oleh energi kinetik, menyebabkan partikel tinta menyebar merata ke seluruh volume air. Semakin banyak energi kinetik yang dimiliki partikel, semakin cepat pula proses difusi terjadi.
Proses Osmosis: Pergerakan Air Melintasi Membran
Osmosis sedikit berbeda. Bayangkan sekarang kamu punya dua larutan dengan konsentrasi berbeda, dipisahkan oleh membran semipermeabel – sejenis membran yang hanya bisa dilewati oleh air, bukan partikel terlarut. Air akan bergerak dari larutan yang berkonsentrasi rendah (hipotonis) ke larutan yang berkonsentrasi tinggi (hipertonis), hingga tercapai kesetimbangan konsentrasi. Ini terjadi karena air berusaha untuk menyamakan konsentrasi di kedua sisi membran. Proses ini penting banget, lho, untuk berbagai proses biologis, seperti penyerapan air oleh akar tumbuhan.
Pengaruh Suhu terhadap Laju Difusi
Suhu berperan penting dalam menentukan seberapa cepat difusi terjadi. Pada suhu tinggi, partikel-partikel bergerak lebih cepat karena energi kinetiknya meningkat. Ilustrasikan ini dengan membayangkan dua gelas berisi air dengan suhu berbeda, masing-masing diberi setetes tinta. Gelas air panas akan menunjukkan penyebaran tinta yang jauh lebih cepat daripada gelas air dingin. Ini karena pada suhu tinggi, partikel tinta ‘berlompatan’ lebih energik dan menyebar lebih efisien.
Faktor-faktor yang Mempengaruhi Laju Difusi dan Osmosis
Proses difusi dan osmosis dipengaruhi oleh beberapa faktor, antara lain: perbedaan konsentrasi (semakin besar perbedaan konsentrasi, semakin cepat prosesnya), suhu (suhu tinggi meningkatkan laju difusi dan osmosis), luas permukaan (luas permukaan yang lebih besar mempercepat proses), dan jarak tempuh (jarak yang lebih pendek mempercepat proses). Selain itu, pada osmosis, jenis membran semipermeabel juga berperan penting.
Perbedaan Difusi dan Osmosis
Meskipun keduanya melibatkan pergerakan partikel, difusi dan osmosis berbeda. Difusi adalah pergerakan partikel dari daerah berkonsentrasi tinggi ke daerah berkonsentrasi rendah, hingga mencapai kesetimbangan konsentrasi. Proses ini bisa terjadi pada berbagai media, termasuk udara dan zat cair. Sementara itu, osmosis merupakan kasus khusus difusi yang hanya melibatkan pergerakan air melintasi membran semipermeabel dari daerah berkonsentrasi tinggi air (konsentrasi zat terlarut rendah) ke daerah berkonsentrasi rendah air (konsentrasi zat terlarut tinggi). Perbedaan utama terletak pada peran membran semipermeabel dalam osmosis.
Viskositas dan Tegangan Permukaan: Gambar Partikel Zat Cair
Pernahkah kamu memperhatikan bagaimana madu mengalir lebih lambat daripada air? Atau bagaimana air membentuk butiran kecil di atas daun talas? Fenomena ini berkaitan erat dengan sifat fisika zat cair, yaitu viskositas dan tegangan permukaan. Dua sifat ini dipengaruhi oleh gaya antarmolekul dan menentukan bagaimana zat cair tersebut berperilaku.
Hubungan Viskositas dan Gaya Antarmolekul
Viskositas, atau kekentalan, merupakan ukuran resistensi suatu zat cair terhadap aliran. Semakin tinggi viskositas, semakin sulit zat cair tersebut mengalir. Hubungannya dengan gaya antarmolekul sangat erat. Gaya antarmolekul yang kuat, seperti ikatan hidrogen pada air, akan menyebabkan viskositas yang lebih tinggi karena molekul-molekul saling berinteraksi dan menghambat pergerakan satu sama lain. Sebaliknya, gaya antarmolekul yang lemah akan menghasilkan viskositas yang rendah.
Pengaruh Viskositas terhadap Aliran Zat Cair
Viskositas secara langsung memengaruhi bagaimana zat cair mengalir. Zat cair dengan viskositas tinggi, seperti madu atau oli mesin, mengalir dengan lambat dan kental. Sementara itu, zat cair dengan viskositas rendah, seperti air atau alkohol, mengalir dengan cepat dan mudah. Perbedaan ini disebabkan oleh perbedaan kekuatan gaya antarmolekul dan hambatan yang ditimbulkan terhadap pergerakan molekul-molekulnya.
Ilustrasi Perbandingan Viskositas
Bayangkan kamu menuangkan air dan madu secara bersamaan dari ketinggian yang sama. Air akan mengalir dengan cepat dan langsung menyebar, sementara madu akan menetes perlahan dan membentuk aliran yang tebal dan lambat. Perbedaan kecepatan aliran ini mencerminkan perbedaan viskositas antara kedua zat cair tersebut. Kita bisa membayangkan ilustrasi dua tabung berisi cairan, satu berisi air yang mengalir deras dan satu berisi madu yang mengalir sangat lambat. Perbedaan kecepatan dan bentuk aliran secara visual akan menunjukkan perbedaan viskositas.
Contoh Zat Cair dengan Viskositas Tinggi dan Rendah
| Zat Cair | Viskositas (Pa·s) pada suhu ruang (perkiraan) | Keterangan | Contoh Penggunaan |
|---|---|---|---|
| Madu | 10 – 100 | Viskositas tinggi | Makanan, pengobatan |
| Oli Mesin | 0.01 – 1 | Viskositas tinggi, bervariasi tergantung jenis oli | Pelumasan mesin |
| Air | 0.001 | Viskositas rendah | Minuman, pembersih |
| Etanol | 0.001 | Viskositas rendah | Pelarut, bahan bakar |
Faktor-faktor yang Memengaruhi Viskositas
Beberapa faktor dapat memengaruhi viskositas suatu zat cair. Suhu merupakan faktor utama; peningkatan suhu umumnya menurunkan viskositas karena energi kinetik molekul meningkat, sehingga molekul lebih mudah bergerak. Tekanan juga dapat memengaruhi viskositas, meskipun pengaruhnya relatif kecil pada kebanyakan zat cair. Struktur molekul zat cair juga berperan penting; molekul yang lebih besar dan kompleks cenderung memiliki viskositas yang lebih tinggi. Terakhir, keberadaan zat terlarut dapat meningkatkan viskositas larutan.
Ketegangan Permukaan dan Kapilaritas
Pernah ngeliat air di gelas membentuk permukaan yang cekung? Atau air naik di sedotan? Itu semua karena fenomena menarik yang disebut ketegangan permukaan dan kapilaritas. Dua hal ini erat kaitannya dan berperan penting dalam berbagai proses di alam, bahkan dalam kehidupan sehari-hari kita!
Hubungan Tegangan Permukaan, Gaya Kohesi, dan Adhesi
Ketegangan permukaan adalah kecenderungan permukaan zat cair untuk menegang dan meminimalkan luas permukaannya. Ini terjadi karena adanya gaya kohesi, yaitu gaya tarik-menarik antar molekul zat cair yang sama. Molekul-molekul di dalam zat cair dikelilingi oleh molekul lain dan gaya tarik-menariknya seimbang. Namun, molekul-molekul di permukaan hanya ditarik oleh molekul di bawah dan sampingnya, menghasilkan gaya netto ke arah dalam. Gaya adhesi, yaitu gaya tarik-menarik antara molekul zat cair dengan molekul zat lain (misalnya dinding wadah), juga berperan. Semakin kuat gaya kohesi dibandingkan adhesi, semakin besar ketegangan permukaan. Sebaliknya, jika gaya adhesi lebih dominan, ketegangan permukaan akan berkurang.
Pengaruh Tegangan Permukaan terhadap Bentuk Permukaan Zat Cair dalam Tabung Kapiler
Dalam tabung kapiler (tabung sempit), tegangan permukaan menyebabkan permukaan zat cair membentuk meniskus. Jika gaya adhesi antara zat cair dan dinding tabung lebih kuat daripada gaya kohesi antar molekul zat cair (seperti pada air dan kaca), meniskus akan cekung ke atas. Sebaliknya, jika gaya kohesi lebih kuat (seperti pada raksa dan kaca), meniskus akan cembung ke atas. Bentuk meniskus ini dipengaruhi oleh keseimbangan antara gaya adhesi dan kohesi.
Ilustrasi Fenomena Kapilaritas
Bayangkan sebuah tabung kapiler tipis dicelupkan ke dalam air. Air akan naik di dalam tabung hingga ketinggian tertentu, melawan gaya gravitasi. Ini karena gaya adhesi antara air dan dinding tabung menarik air ke atas. Gaya kohesi antar molekul air menjaga agar kolom air tetap utuh. Kenaikan air ini disebut kapilaritas. Semakin sempit tabung kapiler, semakin tinggi air akan naik. Sebagai ilustrasi, bayangkan serat kain yang menyerap air, atau sumbu kompor minyak tanah yang menarik minyak ke atas. Prinsipnya sama: kapilaritas.
Aplikasi Kapilaritas dalam Kehidupan Sehari-hari
Kapilaritas adalah fenomena penting dalam banyak proses alami dan teknologi. Tanaman menyerap air dari tanah melalui kapilaritas, sementara kertas menyerap tinta dengan mekanisme yang sama. Bahkan, proses pengiriman nutrisi dalam tubuh kita juga melibatkan prinsip kapilaritas.
Faktor-faktor yang Memengaruhi Ketinggian Zat Cair dalam Tabung Kapiler
- Jari-jari tabung kapiler: Semakin kecil jari-jari, semakin tinggi zat cair akan naik.
- Tegangan permukaan zat cair: Semakin tinggi tegangan permukaan, semakin tinggi zat cair akan naik.
- Densitas zat cair: Semakin tinggi densitas, semakin rendah zat cair akan naik.
- Gaya adhesi antara zat cair dan dinding tabung: Semakin kuat gaya adhesi, semakin tinggi zat cair akan naik.
- Gaya gravitasi: Gaya gravitasi melawan kenaikan zat cair.
Aplikasi Gambar Partikel dalam Memahami Sifat Zat Cair
Zat cair, dengan sifatnya yang dinamis dan beragam, seringkali menjadi tantangan dalam pemahaman dan penerapannya. Namun, dengan bantuan visualisasi partikel, kita bisa “melihat” interaksi molekul dan memahami perilaku zat cair secara lebih mendalam. Model partikel sederhana, yang mempertimbangkan ukuran, jarak, dan gerakan partikel, menjadi kunci untuk mengungkap misteri di balik viskositas, tegangan permukaan, dan difusi zat cair. Lebih dari itu, pemahaman ini membuka jalan bagi inovasi teknologi yang luar biasa.
Model Partikel Sederhana dan Sifat Fisik Zat Cair
Model partikel sederhana, dengan representasi ukuran, jarak, dan gerakan partikel, memberikan gambaran yang intuitif tentang sifat fisik zat cair. Misalnya, viskositas, atau kekentalan, dapat dijelaskan melalui kedekatan dan interaksi antar partikel. Zat cair dengan viskositas tinggi memiliki partikel yang lebih rapat dan berinteraksi lebih kuat, sehingga alirannya lebih lambat. Sebaliknya, zat cair dengan viskositas rendah memiliki partikel yang lebih longgar dan bergerak lebih bebas. Tegangan permukaan, kemampuan zat cair untuk membentuk permukaan yang menyerupai selaput, dijelaskan oleh gaya tarik-menarik antar partikel di permukaan yang lebih kuat daripada gaya tarik-menarik dengan udara di sekitarnya. Difusi, pergerakan partikel dari daerah berkonsentrasi tinggi ke daerah berkonsentrasi rendah, terlihat jelas melalui gerakan acak partikel-partikel zat cair.
Aplikasi Pemahaman Sifat Zat Cair Berbasis Gambar Partikel dalam Teknologi
Pemahaman mendalam tentang sifat zat cair berdasarkan model partikel telah menghasilkan inovasi teknologi yang signifikan. Berikut beberapa contohnya:
- Pengembangan Tinta Printer Inkjet: Viskositas dan tegangan permukaan tinta sangat penting untuk menghasilkan cetakan yang tajam dan akurat. Gambar partikel membantu para ilmuwan merancang tinta dengan viskositas dan tegangan permukaan yang optimal, memastikan tetesan tinta keluar secara merata dan tidak menyebar terlalu banyak di kertas.
- Desain Sistem Pendingin: Efisiensi sistem pendingin, seperti pada CPU komputer, bergantung pada sifat termal zat cair pendingin, termasuk konduktivitas termal dan densitas. Simulasi berbasis gambar partikel membantu dalam mendesain sistem yang memaksimalkan perpindahan panas dan meminimalkan penggunaan energi.
- Pengembangan Bahan Pelumas: Pelumas, seperti oli mesin, harus memiliki viskositas yang tepat pada berbagai suhu. Gambar partikel membantu dalam merancang pelumas yang mempertahankan viskositas optimal pada rentang suhu operasi, meminimalkan gesekan dan keausan pada komponen mesin.
Tabel Aplikasi Pemahaman Sifat Zat Cair dalam Berbagai Bidang
Penggunaan gambar partikel dalam memahami sifat zat cair telah memberikan dampak yang luas di berbagai bidang. Berikut tabel yang merangkumnya:
| Bidang Aplikasi | Sifat Zat Cair yang Relevan | Penerapan Gambar Partikel | Contoh Spesifik |
|---|---|---|---|
| Industri Minyak dan Gas | Viskositas, Densitas, Tekanan | Simulasi aliran fluida dalam pipa | Optimasi desain pipa untuk mengurangi kehilangan tekanan |
| Industri Farmasi | Viskositas, Tegangan Permukaan | Pengembangan formulasi obat yang optimal | Desain sistem pengiriman obat yang tepat sasaran |
| Industri Pangan | Viskositas, Densitas | Pengolahan dan pemrosesan makanan | Optimasi proses pencampuran dan pengadukan |
| Meteorologi | Viskositas, Densitas, Difusi | Pemodelan cuaca dan iklim | Prediksi pola curah hujan dan pergerakan awan |
| Teknik Kimia | Viskositas, Difusi, Reaktivitas | Desain reaktor kimia | Optimasi proses reaksi kimia |
Perancangan dan Pengembangan Produk dengan Simulasi Gambar Partikel
Simulasi komputer berbasis gambar partikel merupakan alat yang ampuh dalam merancang dan mengembangkan produk yang melibatkan zat cair. Misalnya, dalam desain sistem penyemprotan, simulasi dapat memprediksi pola penyemprotan dan ukuran tetesan, memastikan distribusi yang merata dan efisien. Visualisasi partikel memungkinkan para insinyur untuk mengoptimalkan desain nosel dan tekanan penyemprotan untuk mencapai hasil yang diinginkan. Sebagai ilustrasi, bayangkan sebuah diagram skematis yang menunjukkan bagaimana partikel-partikel cairan terdistribusi dalam ruang tiga dimensi, menunjukkan pola penyemprotan yang optimal.
Manfaat Penggunaan Gambar Partikel dalam Memahami Perilaku Zat Cair
Penggunaan gambar partikel menawarkan sejumlah manfaat dalam memahami perilaku zat cair dalam berbagai kondisi:
- Visualisasi yang Intuitif: Gambar partikel memberikan representasi visual yang mudah dipahami tentang perilaku zat cair, bahkan untuk konsep yang kompleks seperti difusi dan tegangan permukaan.
- Prediksi Perilaku: Simulasi berbasis gambar partikel memungkinkan prediksi perilaku zat cair dalam berbagai kondisi, seperti perubahan suhu dan tekanan, tanpa perlu melakukan eksperimen yang mahal dan memakan waktu.
- Optimasi Desain: Gambar partikel membantu dalam mengoptimalkan desain produk yang melibatkan zat cair, seperti sistem pendingin atau pipa aliran fluida.
- Pemahaman Interaksi Partikel: Gambar partikel memungkinkan pengamatan langsung tentang bagaimana partikel-partikel zat cair berinteraksi satu sama lain dan dengan lingkungan sekitarnya.
- Analisis Sensitivitas: Simulasi berbasis gambar partikel memungkinkan analisis sensitivitas terhadap perubahan parameter, seperti viskositas atau suhu, untuk mengidentifikasi faktor-faktor yang paling berpengaruh pada perilaku zat cair.
Langkah-Langkah Analisis Sifat Zat Cair Menggunakan Gambar Partikel
Berikut diagram alir langkah-langkah analisis sifat zat cair menggunakan gambar partikel:
(Diagram alir akan berupa deskripsi teks karena keterbatasan format HTML, misalnya: 1. Definisikan sistem dan sifat zat cair yang akan dianalisis. 2. Buat model partikel sederhana yang merepresentasikan sistem tersebut. 3. Lakukan simulasi numerik berdasarkan model partikel. 4. Analisis hasil simulasi dan interpretasikan data. 5. Validasi hasil simulasi dengan data eksperimen (jika tersedia). 6. Buat kesimpulan dan rekomendasi.)
Perbandingan Metode Analisis Sifat Zat Cair
Gambar partikel memiliki kelebihan dan kekurangan jika dibandingkan dengan metode lain dalam menganalisis sifat zat cair.
| Metode | Kelebihan | Kekurangan |
|---|---|---|
| Gambar Partikel | Visualisasi yang intuitif, prediksi perilaku, optimasi desain | Perlu komputasi yang intensif, tingkat akurasi bergantung pada model yang digunakan |
| Eksperimen Laboratorium | Data yang akurat dan terpercaya | Mahal, memakan waktu, dan mungkin berbahaya |
| Pemodelan Matematika | Prediksi yang akurat untuk sistem yang sederhana | Kompleks untuk sistem yang kompleks, sulit divisualisasikan |
Keterbatasan dan Cara Mengatasi Keterbatasan Penggunaan Gambar Partikel
Meskipun bermanfaat, gambar partikel memiliki keterbatasan. Model partikel yang disederhanakan mungkin tidak sepenuhnya merepresentasikan kompleksitas interaksi molekul dalam zat cair nyata. Akurasi simulasi juga bergantung pada kualitas model dan kemampuan komputasi. Keterbatasan ini dapat diatasi dengan menggunakan model partikel yang lebih canggih, meningkatkan daya komputasi, dan memvalidasi hasil simulasi dengan data eksperimen.
Perbandingan Model Partikel Zat Cair Sederhana dan Kompleks
Memahami perilaku zat cair membutuhkan model yang akurat. Model partikel zat cair, baik sederhana maupun kompleks, menawarkan cara untuk memvisualisasikan dan memprediksi sifat-sifatnya. Namun, tingkat detail dan akurasi yang ditawarkan oleh masing-masing model sangat berbeda, memengaruhi penerapannya dalam berbagai situasi.
Model Partikel Zat Cair Sederhana vs. Kompleks: Asumsi Dasar
Model partikel sederhana, seringkali digambarkan sebagai model bola billiard, berasumsi bahwa partikel zat cair berbentuk bola identik, keras, dan tidak saling berinteraksi kecuali melalui tumbukan elastis. Model ini mengabaikan gaya antarmolekul seperti gaya Van der Waals dan ikatan hidrogen. Sebaliknya, model kompleks memperhitungkan gaya-gaya antarmolekul tersebut, mengakui bentuk partikel yang mungkin tidak sempurna dan interaksi yang lebih rumit daripada sekadar tumbukan.
Keterbatasan Model Sederhana dalam Menggambarkan Sifat Zat Cair
Model sederhana gagal menjelaskan beberapa sifat zat cair penting. Misalnya, viskositas (kekentalan) tidak dapat dijelaskan dengan baik karena model ini mengabaikan gaya tarik-menarik antarmolekul yang memengaruhi aliran zat cair. Tegangan permukaan, kemampuan zat cair untuk membentuk permukaan yang minim energi, juga tidak dapat dijelaskan karena model ini tidak memperhitungkan gaya kohesi antarmolekul di permukaan. Difusi, pergerakan partikel dari daerah berkonsentrasi tinggi ke daerah berkonsentrasi rendah, juga hanya dapat dijelaskan secara terbatas karena model ini tidak memperhitungkan interaksi antarmolekul yang memengaruhi gerakan partikel.
Sebagai contoh, model sederhana tidak dapat memprediksi mengapa air memiliki tegangan permukaan yang tinggi, memungkinkan serangga berjalan di atas air. Model sederhana juga tidak dapat menjelaskan mengapa viskositas madu jauh lebih tinggi daripada viskositas air pada suhu kamar.
Ilustrasi Perbandingan Kedua Model
Model sederhana digambarkan sebagai susunan bola-bola identik yang terpisah dengan jarak relatif konstan, bergerak secara acak dengan tumbukan elastis. Tidak ada interaksi khusus antar bola selain tumbukan. Sebaliknya, model kompleks menunjukkan susunan partikel yang lebih rapat, dengan jarak antar partikel bervariasi tergantung pada gaya antarmolekul. Beberapa partikel mungkin saling berdekatan karena gaya tarik-menarik, sementara yang lain terpisah lebih jauh. Panah dapat ditambahkan untuk menggambarkan gaya tarik-menarik dan tolak-menolak antar partikel.
Perbandingan Model Sederhana dan Kompleks
| Aspek Perbandingan | Model Sederhana | Model Kompleks | Contoh Perbedaan dalam Perilaku Zat Cair |
|---|---|---|---|
| Asumsi Partikel | Bola identik, keras, tidak berinteraksi kecuali tumbukan elastis | Bentuk dan ukuran partikel bervariasi, interaksi melalui gaya antarmolekul (Van der Waals, ikatan hidrogen, dll.) | Model sederhana tidak dapat menjelaskan tegangan permukaan air, sementara model kompleks dapat. |
| Interaksi Antar Partikel | Hanya tumbukan | Gaya tarik-menarik dan tolak-menolak | Model sederhana tidak dapat menjelaskan viskositas yang berbeda antara air dan madu, sementara model kompleks dapat. |
| Akurasi Prediksi | Rendah untuk sifat-sifat seperti viskositas, tegangan permukaan, dan difusi | Tinggi untuk sifat-sifat seperti viskositas, tegangan permukaan, dan difusi | Model sederhana tidak dapat memprediksi difusi yang akurat, sementara model kompleks dapat memperhitungkan faktor-faktor seperti ukuran partikel dan gaya antarmolekul. |
Pentingnya Memilih Model yang Tepat
Menggunakan model partikel yang sesuai sangat penting untuk mendapatkan prediksi yang akurat. Model sederhana cukup akurat untuk menggambarkan perilaku gas ideal pada tekanan dan suhu rendah. Namun, untuk menggambarkan perilaku zat cair yang lebih kompleks, model yang memperhitungkan gaya antarmolekul diperlukan. Penggunaan model yang tidak sesuai dapat menyebabkan kesalahan prediksi yang signifikan, mempengaruhi interpretasi data dan pengambilan keputusan.
Pengaruh Suhu dan Tekanan pada Model Kompleks
Suhu memengaruhi energi kinetik partikel. Pada suhu tinggi, partikel bergerak lebih cepat dan gaya antarmolekul menjadi kurang signifikan relatif terhadap energi kinetik. Tekanan memengaruhi jarak antar partikel. Tekanan tinggi memaksa partikel lebih dekat, meningkatkan kekuatan gaya antarmolekul. Perubahan suhu dan tekanan ini akan memengaruhi viskositas, tegangan permukaan, dan difusi zat cair.
Sifat Zat Cair yang Dijelaskan Lebih Akurat oleh Model Kompleks, Gambar partikel zat cair
- Viskositas: Model kompleks dapat menjelaskan perbedaan viskositas antar zat cair dengan memperhitungkan kekuatan gaya antarmolekul.
- Tegangan Permukaan: Model kompleks menjelaskan tegangan permukaan melalui gaya kohesi antarmolekul di permukaan zat cair.
- Difusi: Model kompleks memperhitungkan interaksi antarmolekul yang memengaruhi kecepatan difusi.
Alur Pemilihan Model Partikel yang Tepat
Berikut adalah flowchart sederhana untuk membantu memilih model partikel yang tepat:
[Di sini seharusnya ada flowchart, namun karena batasan format, deskripsi akan diberikan. Flowchart dimulai dengan pertanyaan: “Apakah sifat zat cair sederhana (seperti gas ideal pada suhu dan tekanan rendah)?”. Jika ya, gunakan model sederhana. Jika tidak, lanjutkan ke pertanyaan berikutnya: “Apakah akurasi tinggi dibutuhkan untuk memprediksi sifat-sifat seperti viskositas, tegangan permukaan, dan difusi?”. Jika ya, gunakan model kompleks. Jika tidak, pertimbangkan kembali kebutuhan akurasi dan pilih model yang sesuai.]
Pemodelan Komputer Gerakan Partikel Zat Cair

Bayangkan kamu bisa melihat setiap molekul air bergerak dalam segelas air, menari-nari dan bertabrakan satu sama lain. Kedengarannya mustahil, kan? Tapi dengan keajaiban pemodelan komputer, hal itu kini memungkinkan. Simulasi komputer memungkinkan kita untuk meniru perilaku kompleks zat cair di tingkat mikroskopis, membuka jalan untuk pemahaman yang lebih mendalam tentang sifat-sifat fluida dan aplikasinya di berbagai bidang.
Simulasi komputer menggunakan algoritma numerik untuk menyelesaikan persamaan yang menggambarkan interaksi antara partikel-partikel dalam zat cair. Dengan kekuatan komputasi yang semakin meningkat, simulasi ini mampu menangani jutaan, bahkan miliaran partikel, menghasilkan visualisasi yang realistis dan data kuantitatif yang berharga.
Keuntungan dan Kerugian Simulasi Komputer
Simulasi komputer menawarkan sejumlah keuntungan signifikan dalam studi gerakan partikel zat cair. Kemampuan untuk mengontrol parameter-parameter tertentu, seperti suhu dan tekanan, dan mengamati dampaknya secara langsung, menjadikannya alat yang tak ternilai harganya. Selain itu, simulasi memungkinkan untuk menyelidiki fenomena yang sulit atau bahkan mustahil untuk diamati secara eksperimen.
- Keuntungan: Kontrol parameter yang presisi, pengamatan fenomena yang sulit diamati secara eksperimen, penghematan biaya dan waktu dibandingkan eksperimen skala besar, dan kemampuan untuk menganalisis data secara detail.
- Kerugian: Membutuhkan sumber daya komputasi yang signifikan, keakuratan hasil simulasi bergantung pada kualitas model dan parameter yang digunakan, serta kompleksitas dalam interpretasi data yang dihasilkan.
Contoh Simulasi Komputer Gerakan Partikel
Salah satu contoh simulasi yang umum adalah simulasi dinamika molekuler (MD). Dalam simulasi MD, gerakan setiap partikel dihitung berdasarkan interaksi dengan partikel di sekitarnya. Bayangkan sebuah ilustrasi: ribuan bola kecil yang mewakili molekul air bergerak secara acak dalam sebuah kotak. Warna dan ukuran bola bisa merepresentasikan sifat-sifat molekul, seperti kecepatan dan energi. Kita bisa melihat bagaimana bola-bola ini bertabrakan, membentuk ikatan hidrogen, dan menciptakan pola aliran yang kompleks. Simulasi ini bisa digunakan untuk mensimulasikan aliran air di pipa, perilaku gelembung udara dalam air, atau bahkan proses difusi molekul.
Aplikasi Simulasi Komputer dalam Penelitian dan Pengembangan
Simulasi komputer telah menjadi alat yang esensial dalam berbagai bidang penelitian dan pengembangan, dari desain obat dan material hingga prediksi cuaca dan optimasi proses industri. Kemampuan untuk mensimulasikan perilaku sistem kompleks pada skala mikroskopis telah menghasilkan terobosan signifikan dalam pemahaman dan pengembangan teknologi baru. – Prof. Dr. X (Contoh kutipan)
Parameter Penting dalam Simulasi Komputer
Keakuratan simulasi komputer sangat bergantung pada pemilihan parameter yang tepat. Beberapa parameter penting yang perlu dipertimbangkan meliputi:
| Parameter | Penjelasan |
|---|---|
| Jumlah partikel | Jumlah partikel yang disimulasikan mempengaruhi akurasi dan kompleksitas komputasi. |
| Potensial interaksi | Model interaksi antar partikel (misalnya, Lennard-Jones, Coulomb) mempengaruhi perilaku sistem. |
| Suhu dan tekanan | Kondisi termodinamika mempengaruhi gerakan partikel dan sifat-sifat zat cair. |
| Ukuran kotak simulasi | Ukuran kotak simulasi harus cukup besar untuk menghindari efek batas. |
| Langkah waktu | Langkah waktu yang terlalu besar dapat menyebabkan ketidakakuratan, sementara langkah waktu yang terlalu kecil membutuhkan waktu komputasi yang lama. |
Penutupan Akhir
Perjalanan kita mengungkap rahasia gambar partikel zat cair telah sampai pada akhir. Ternyata, dunia mikroskopis yang tersembunyi di balik setiap tetesan air, setitik minyak, atau segelas jus buah menyimpan keajaiban yang luar biasa. Memahami susunan, gerakan, dan interaksi antar partikel memberikan kita pemahaman yang lebih mendalam tentang sifat-sifat makroskopis zat cair. Dari viskositas hingga tegangan permukaan, semuanya terhubung erat dengan tarian partikel-partikel yang tak terlihat. Semoga pemahaman ini membuka wawasan baru dan menginspirasi eksplorasi lebih lanjut dalam dunia ilmu pengetahuan yang menakjubkan ini.


What's Your Reaction?
-
0
 Like
Like -
0
 Dislike
Dislike -
0
 Funny
Funny -
0
 Angry
Angry -
0
 Sad
Sad -
0
 Wow
Wow








